SCANnTREAT, diagnostiquer et traiter les tumeurs cancéreuses
Frédéric Lerouge, lauréat de l’appel FETOpen 2020, participe au développement d'un dispositif innovant pour réaliser en temps réel et simultanément le diagnostic et le traitement de tumeurs cancéreuses. Découvrez son portrait...
Frédéric Lerouge est Ma?tre de conférences à l’Université Claude Bernard Lyon 1. Spécialiste de la chimie des matériaux, il a élaboré avec ses collègues au Laboratoire de chimie de Lyon un système de nano-particules multimodales pour l’imagerie médicale. Sur cette base, il a obtenu dans le cadre de l’appel FETOpen 2020 un financement pour développer un dispositif innovant réalisant en temps réel et simultanément le diagnostic et le traitement des tumeurs cancéreuses.
Quel est l’objectif du projet SCANnTREAT ?
Ce projet vise à proposer un dispositif permettant à la fois de diagnostiquer et de traiter une tumeur cancéreuse. Actuellement, le diagnostic, la thérapie et le suivi du traitement s’effectuent dans des services hospitaliers différents. Cela signifie prendre plusieurs rendez-vous, changer de lieux et faire des allers-retours entre les différents services... C’est un processus très lourd pour les personnes malades. Nous proposons dans le projet SCANnTREAT de réaliser ces différentes étapes avec un même dispositif en combinant une technique d’imagerie de scanner et une thérapie innovante aux rayons X. Le lien entre ces deux techniques est possible gr?ce à des nanoparticules multifonctionnelles que nous avons développées au laboratoire de chimie de Lyon (LCH) (1).
Quel type de nanoparticules ?
Avec Frédéric Chaput et Stéphane Parola, nos recherches au LCH portent sur l’élaboration de systèmes de nano-particules utilisables en tant qu’agents de contraste pour l’imagerie médicale. Frédéric Chaput a notamment développé un procédé - aujourd’hui breveté - pour obtenir des suspensions de nano-particules de fluorures de terres rares extrêmement stables. Or en imagerie, certaines terres rares sont couramment utilisées comme agents de contraste. Ces produits injectés dans l’organisme augmentent le contraste des images afin de mieux visualiser les organes, ou les tumeurs. Aujourd’hui, la plupart des agents de contraste utilisés en IRM et validés par les autorités sanitaires sont des dérivés d’une terre rare en particulier : le Gadolinium.
Gr?ce au procédé de Frédéric Chaput, nous avons élaboré des fluorures de Gadolinium et avons validé ses propriétés en tant que système indiqué pour l’IRM. Nous l’avons testé dans le cadre de différents projets comme l’imagerie de la plaque amylo?de - qui se développe dans les premières phases d’Alzheimer – ou de l’AVC.
Comment êtes-vous ensuite passés de l’IRM au scanner ?
Le Gadolinium est très utilisé en IRM en raison de ses propriétés magnétiques, mais c’est aussi un élément suffisamment ? lourd ? pour absorber les rayons X. Cela signifie qu’il constitue théoriquement un agent de contraste pour l’imagerie par scanner. Nous avons ainsi pu montrer que les fluorures de Gadolinium présentent des contrastes comparables aux agents utilisés en clinique, pour une concentration similaire, avec le scanner.
Avec ce système, nous pouvons ainsi combiner IRM et scanner et même faire de l’imagerie spectrale. Nous avons poursuivi cette approche d’imagerie dite ? multimodale ? en collaborant avec Philippe Douek (2) qui s’intéresse à la mise en place d’un nouveau scanner d’imagerie appelé scanner spectral à comptage de photons (SPPCT).
Quelle différence entre le scanner classique et le scanner SPCCT ?
Le scanner SPCCT est la nouvelle génération de scanners. Si vous voulez, c’est un peu comme de passer de la télévision noir et blanc à la télévision couleur.
Avec un scanner classique, le contraste de l’image est d? à l’agent de contraste utilisé mais aussi aux tissus biologiques qui absorbent une partie des rayons X. Avec le scanner SPCCT, il est possible d’être spécifique de l’élément constituant l’agent de contraste, de le localiser plus précisément avec une meilleure résolution, mais aussi et surtout de le doser et le quantifier in situ.
Au cours de notre collaboration avec Philippe Douek dans le cadre du projet SPCCT - un prototype est actuellement développé à Lyon par la société Philips– a alors émergé la question de combiner diagnostic et traitement.
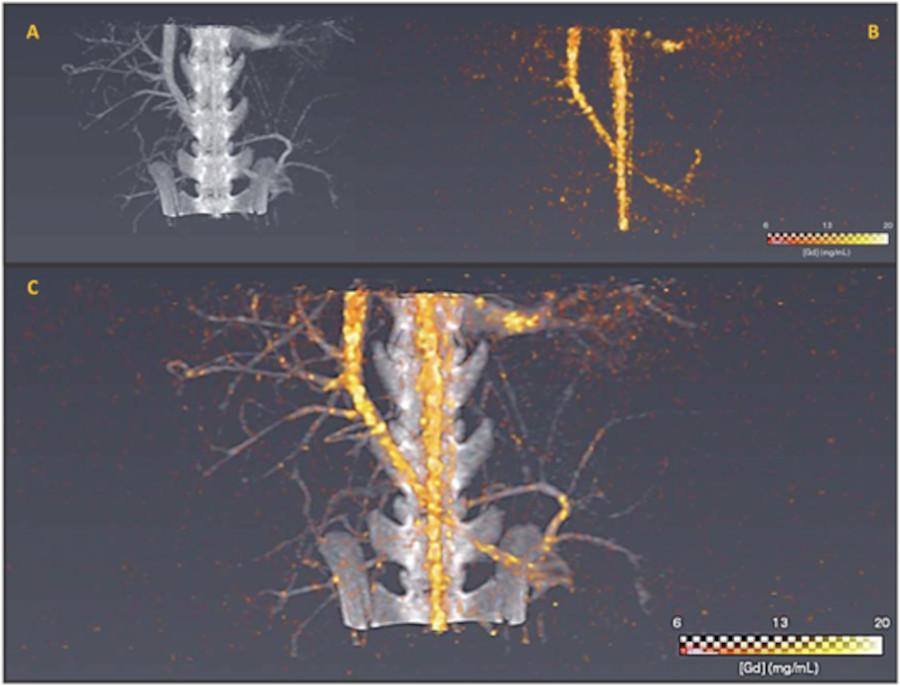
Images obtenues avec les fluorures de Gadolinium au SPCCT (abdomen de rat) ; Image A : scanner classique ; Image B : scanner SPCCT ; Image C : association des images A et B.
Comment alors combiner diagnostic et traitement ?
Puisque notre système fonctionne pour l’imagerie au scanner SPCCT, nous avons cherché une thérapie également basée sur les rayons X. La radiothérapie est très utilisée pour le traitement de tumeurs, mais elle fait intervenir des rayonnements de haute énergie qui peuvent avoir des effets néfastes sur les tissus sains qui environnent les tumeurs. De plus, avec le scanner spectral les gammes d’énergie que nous utilisons sont bien inférieures à celles utilisées en radiothérapie.
Dans le cadre de SCANnTREAT nous nous intéressons à une modalité de traitement en plein essor : la thérapie photodynamique activée par rayons X. La thérapie photodynamique seule, utilisée pour le traitement de certains types de cancers, repose sur l’utilisation de photosensibilisants qui ont la capacité de devenir toxiques uniquement lorsqu’ils sont soumis à un certain type de lumière. Hélas, le fait que cette dernière ne pénétre pas ou peu dans le corps humain, réduit les possibilités de traitement dans l’organisme. Pour pallier cette limitation, l’idée de la thérapie photodynamique activée par rayons X est de rendre actifs les photosensibilisants en utilisant des systèmes particuliers capables de générer de la lumière lorsqu’ils sont soumis à des rayons X. Or, c’est justement l’une des propriétés de certaines terres rares que l’on appelle la scintillation.
Les nanoparticules de fluorures de terres rares que l’on se propose de préparer dans le cadre de ce projet vont associer ces technologies : scintillation et photosensibilisant et permettront d’utiliser une thérapie plus douce que la radiothérapie, avec les rayonnements du scanner.
Les systèmes à base de fluorures de Gadolinium constituent ainsi le lien entre l’imagerie, le dosage in situ et la thérapie photadynamique activée par rayons X sur une même machine : le scanner spectral.
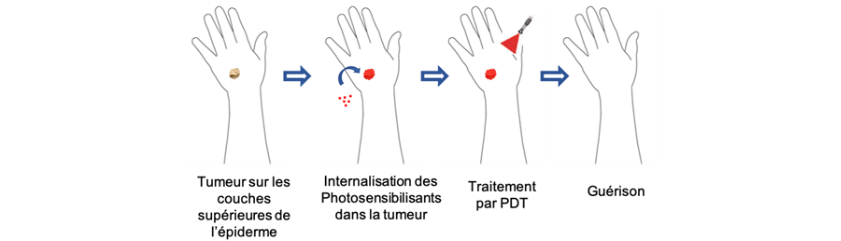
Principe de la Thérapie photodynamique (PDT)
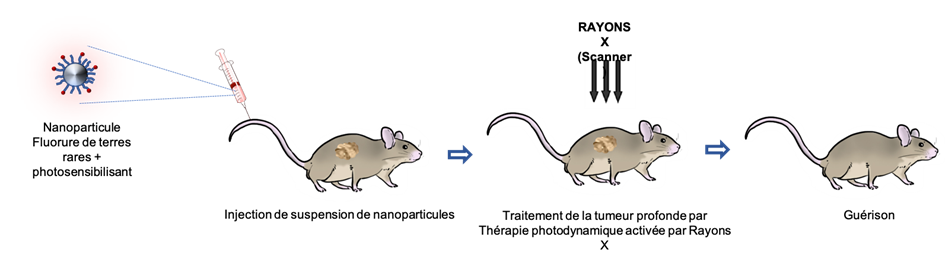
Principe de la thérapie photodynamique activée par rayons X
Ce projet présente donc une forte composante interdisciplinaire…
Ce projet est la concrétisation de nombreuses rencontres faites au fil des années et l’alliance de diverses compétences. Dans l’équipe nous sommes spécialistes de la chimie des matériaux, nous avons la chance de pouvoir interagir avec des chercheurs spécialisés dans la chimie des chromophores au sein du laboratoire, mais nous avons également eu des échanges fructueux avec de nombreux collaborateurs au travers de projets nationaux ou européens. La collaboration avec Philippe Douek s’est avérée particulièrement précieuse pour développer ce système d’imagerie multimodale.
D’ailleurs, le consortium que nous avons créé dans le cadre du projet SCANnTREAT intègre des praticiens afin de nous aiguiller sur les types de cancers que nous pourrions envisager de traiter, comment les particules répondent aux rayons X, et comment elles sont acceptées par l’organisme. Il est évident que ce type de projet ne saurait se mettre en place sans aides financières telles que l’appel FETOPEN.
Et sur l'aspect formation ?
Des doctorants ont commencé en 2020 leur thèse sur ce projet ainsi que des post-doctorants. C’est très important pour nous car la recherche ne saurait se faire sans eux. Ce sont eux qui matérialisent les idées. Peut-être encore plus en chimie ou les idées se font au fur et à mesure des expériences. C’est pourquoi, même avec les contraintes actuelles, il est important de rester sur le terrain, au contact de ces jeunes chercheurs.
D’autre part, ces projets européens sont aussi des tremplins à l’international pour eux. Nous voulons leur donner la possibilité d’interagir entre eux pour faire avancer le projet, créer leur réseau et pouvoir développer leur propre recherche. C’est aussi une fa?on de les former aux technologies qui nous soignerons peut-être dans le futur.
(↑1) Laboratoire de chimie de Lyon (LCH - CNRS/ENS de Lyon)
(↑2) Philippe Douek est professeur des universités à l'Université Lyon 1, Praticien hospitalier aux Hospices civils de Lyon et chercheur au Centre de recherche en acquisition et traitement de l'image pour la sante (CREATIS - Université Claude Bernard Lyon 1/CNRS/INSA Lyon/INSERM)



 fr
fr en
en
 es
es

